Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
中川 洋
no journal, ,
蛋白質ダイナミクスは水和水ダイナミクスとカップルしている。われわれは分子動力学シミュレーションと中性子非干渉性準弾性散乱により、蛋白質水和水の拡散運動をさまざまな水和量で調べた。まず分子動力学シミュレーションで調べた結果、水和水のパーコレーション転移において、拡散係数の顕著な抑制が見られた。またこのことは中性子準弾性散乱実験からも実証された。実験データは、水和水ダイナミクスがジャンプ拡散運動で記述できることを示した。またこのモデルにおける水の滞在時間は水分子間の水素結合のキネティクスと良い相関があることがわかった。
河野 秀俊; 米谷 佳晃; 池部 仁善; 櫻庭 俊; 石田 恒
no journal, ,
Eukaryotic Genome is stored in a nucleus in the form of chromatin. Along with DNA binding proteins, this chromatin structure plays a key role in gene regulation. The chromatin has the fundamental structural unit called nucleosome which is composed of two copies of histones H2A, H2B, H3 and H4 and DNA wrapped around the histone proteins almost twice. Transcription does not occur until nucleosome is unwrapped to expose DNA, which can then be recognized by regulatory proteins. To understand this unwrapping process, MD simulations were performed on two nucleosomes: the canonical H3 and the H3 variant called CENP-A, essential for the kinetochore assembly. In the talk, how these nucleosomes are different in free energy profiles and what causes the differences are discussed.
目次 正一*; 上野山 敦子*; 久保 純*; 宮田 真人*; 河野 秀俊; 由良 敬*; 郷 信広*
no journal, ,
Mycoplasma mobile glides at an average velocity of about 2.0 to 4.5 micro m/s, about ten times faster than the other mycoplasmas. The motile mechanism of M. mobile has been believed to differ from any previously identified mechanisms not only in bacteria but also in any other species. To reveal the mechanism, we carried out sequence analyses of Gli349 which is responsible for both adhesion to glass surfaces and motility, and its ortholog MYPU2110 from Mycoplasma pulmonis. We found that Gli349 contains 18 repeats of about 100 amino acid residues each in 3,183 residues, and MYPU2110 contains 22 in 3,216 residues. We also showed that the repeat was not homologous to any other known protein and therefore predicted three-dimensional structure. The model structure of Gli349 was proposed which fit well to the images obtained by electron microscopy, assuming that the cleavage by chymotrypsin tend to occur in the regions between the repeats, and that each repeat folds into an independent structural domain. Based on this model, with inhibitory antibodies and mutants, the regions directly involved in movements of M. mobile was suggested on Gli349 and Gli521, which is also involved in the gliding machinery. A further study suggested that Gli349 should be a "leg" for the motile apparatus with Gli521 that plays a role of a "crank" for M. mobile. In the presentation, such a unique motile mechanism of M. mobile being elucidated is introduced.
池部 仁善; 櫻庭 俊; 河野 秀俊
no journal, ,
A novel, efficient sampling method for biomolecules is proposed. The partial multicanonical molecular dynamics (partial McMD) was recently developed as a generalized ensemble (GE) method to focus sampling only on a part of a system (GEPS); however, it was not tested well. We found that partial McMD did not work well for poly-lysine decapeptide and gave significantly worse sampling efficiency than a conventional GE. Herein, we elucidate the fundamental reason for this and propose a novel GEPS, adaptive lambda square dynamics (ALSD), which can resolve the problem faced when using partial McMD. We demonstrate that ALSD greatly increases the sampling efficiency over a conventional GE.
松尾 龍人; 荒田 敏昭*; 小田 俊郎*; 藤原 悟
no journal, ,
筋肉収縮に関わる蛋白質であるF-アクチン及びミオシンS1周辺水和水の構造・ダイナミクスを中性子・X線小角散乱及び中性子準弾性散乱を用いて調べた。S1水和水の密度はバルク水よりも10-15%大きく、運動性がバルク水よりも遅いという典型的な水和水の特性を備えていた。一方、F-アクチン水和水の密度はバルク水よりも19%以上大きく、運動性もバルク水に近いという特殊な性質を示した。これらの結果は、蛋白質水和水の構造・ダイナミクス特性に多様性が存在することを示唆している。F-アクチン水和水の特殊な性質は、F-アクチン周辺に存在するとされている「ハイパーモバイル水」に関連している可能性が考えられる。
赤松 憲; 鹿園 直哉
no journal, ,
DNAに生じた傷(DNA損傷)のほとんどは生物が有する損傷修復機構によって元通りに修復されるが、中には修復困難なタイプの傷があり、これが突然変異や発癌の原因になるといわれている。修復困難とされる損傷型のひとつに「クラスター損傷」(複数の損傷がDNA鎖上の狭い領域に集中的に生じている)がある。しかしながら、その化学構造・損傷局在の程度・生成頻度等の実体はほとんど明らかになっていない。そこで我々は、このような仮説的な損傷を実験的に解明するために、蛍光共鳴エネルギー移動を利用した損傷位置局在性評価法(FRET法)の開発を行ってきた。既知の損傷のひとつである「脱塩基部位」(AP)がランダムに生じていると予想される熱処理済DNAをモデルとして用い、その実験データ、及び損傷間隔がランダムな場合(指数分布)の理論値を比較した。その結果、両者は概ね一致することが分かった。また、実際に放射線の一種である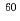 Co
Co 線(標準的な放射線), ヘリウム,炭素粒子線(クラスター損傷が生じやすいとされる放射線の一種)を照射したDNAに対して本FRET法を適用した。それらの結果も合わせて報告する。
線(標準的な放射線), ヘリウム,炭素粒子線(クラスター損傷が生じやすいとされる放射線の一種)を照射したDNAに対して本FRET法を適用した。それらの結果も合わせて報告する。
石田 恒
no journal, ,
Proteasome is involved in the degradation of the majority of cellular proteins. Proteasome activators bind to 20S proteasome core particle (CP) and facilitate opening a gate on the end of the CP. Then, the CP allows protein substrates to move into its interior through a channel between the gate and the alpha-annulus in order to hydrolyze the substrates to small fragments, and releases the products outside. To understand the gating mechanism of the CP, molecular dynamics simulations of the CP complexed with a PAN (analog of ATP-dependent 19S activator)-like activator, and of the CP complexed with an ATP-independent PA26 activator. The free-energies of the translocation of a poly-peptide substrate through the channel of these complexes were estimated.
村上 洋
no journal, ,
ナノメートルスケールの微小液滴を保持する逆ミセルは、水の構造・ダイナミクスに及ぼす空間拘束効果を調べるだけでなく、また、その微少液滴中に蛋白質などを可溶化することができるため、細胞類似環境下での生体高分子や水の状態を調べるために有用な系である。テラヘルツ(THz)分光を用いた水の融点より上の温度変化研究は、228Kでの過冷却水の熱力学量の異常性の存在を支持する。本研究では、水のテラヘルツダイナミクスの空間拘束効果の温度依存性を調べるために、逆ミセル中の水を対象に、水の融点付近以上でTHz分光及び動的光散乱の温度変化測定を実施した。逆ミセルの調製には界面活性剤AOT、油溶媒イソオクタンと超純水を用い、半径約2から5nmの範囲で水滴半径を変化させた。また、THz時間領域分光において水に起因する信号を取得するために、試料と参照試料を同時に温度制御し測定できる装置を開発した。バルク水で観測される10ps程度の緩和が逆ミセル中でも観測されたが、その時定数の温度変化は水滴半径に依存し、拘束空間内での水素結合ネットワーク形成に基づいて理解できる。
藤原 悟; 松尾 龍人; 山田 武*; 高橋 伸明*; 蒲沢 和也*; 川北 至信; 柴田 薫
no journal, ,
In order to investigate the role of protein dynamics in the regulatory mechanism of muscle contraction, we carried out neutron inelastic scattering experiments on the native thin filaments (NTF) in the presence and absence of Ca and F-actin using the dynamics analysis spectrometer DNA at J-PARC. The mean square displacements estimated from the elastic incoherent neutron scattering measurements showed that NTF in the -Ca
and F-actin using the dynamics analysis spectrometer DNA at J-PARC. The mean square displacements estimated from the elastic incoherent neutron scattering measurements showed that NTF in the -Ca state is more dynamically disordered than in the +Ca
state is more dynamically disordered than in the +Ca state. Comparison with F-actin suggests that the difference arises from the regulatory proteins. The dynamic change in the regulatory proteins suggests that the dynamics of these proteins plays an important role in the regulatory mechanism of muscle contraction.
state. Comparison with F-actin suggests that the difference arises from the regulatory proteins. The dynamic change in the regulatory proteins suggests that the dynamics of these proteins plays an important role in the regulatory mechanism of muscle contraction.